Vor der Registrierung von Medizinprodukten in China
Voraussetzung für die Registrierung von Medizinprodukten
Eine der wichtigsten Voraussetzungen für die Registrierung eines Medizinprodukts in China ist die Genehmigung des Herkunftslandes: z. B. Konformitätserklärung (EU)/Zertifikat für eine ausländische Regierung (USA). Eine Ausnahme von dieser Voraussetzung bilden innovative Produkte.
Idealerweise verfügen Sie über eine grundlegende technische Dokumentation.
Dann müssen Sie einen chinesischen Vertreter für ausländische Hersteller finden, der das Produktdossier bei der NMPA einreicht und als Verbindungsmann zwischen der Behörde und dem legalen Hersteller fungiert.
Von der Erstellung bis zur Einreichung technischer Dossiers dauert es in der Regel lange. Die Herkunftslandgenehmigung muss spätestens zum Zeitpunkt der Einreichung des Dossiers bei der NMPA vorliegen. Bis zur endgültigen Produktgenehmigung wird es angesichts der Typprüfung und zusätzlicher Anforderungen der NMPA unvorhersehbar zeitaufwändig sein.
Produktklassifizierung und Produktcode des Medizinprodukts
Ähnlich wie beim Produktcode bei der FDA können Sie Ihre Produkte selbst klassifizieren!
Produktklassifizierung von Medizinprodukten in China
In China gibt es drei Klassen (I, II und III) von Medizinprodukten. Je höher das Risiko, das das medizinische Gerät eingeht, desto höher ist die Klassifizierung. Für Medizinprodukte der Klasse I ist lediglich eine Auflistung (Archivierung) erforderlich, und für Medizinprodukte der Klassen II und III ist ein umfangreiches Genehmigungsverfahren erforderlich (Artikel 13, 15 und 16, Staatsratsverordnung 739, 2021).
Das Zertifikat der MD-Klasse I ist unbegrenzt gültig und das Zertifikat der MD-Klassen II und III ist 5 Jahre lang gültig.
Chinesischer Produktcode
Als Produktcode (oder Regulierungsnummer) bei der FDA in den USA gibt es auch in China ein Produktcodesystem für Medizinprodukte. Die Klassifizierung von Medizinprodukten basierend auf dem Produktcode-Katalog (nur auf Chinesisch) wurde 2018 von der NMPA herausgegeben. Der Produktcode ist 6-stellig. Es gibt 22 Hauptproduktkategorien. Je nach Verwendungszweck können Medizinprodukte in präzise 6-stellige Produktcodes und Zugehörigkeitsklassifizierungen eingeteilt werden.
Bislang gibt es im Jahr 2023 in China 1834 generische Produktcodes, verglichen mit 1700 generischen Gerätetypen in den USA, die aus 16 Produktgruppen bestehen.
Der chinesische Produktcode ist ausschlaggebend für die Produktklassifizierung und unterscheidet sich von der Zertifizierungsnummer nach der Produktzulassung.
Wir listen hier 22 Hauptproduktkategorien auf, die die ersten 2 Ziffern des 6-stelligen Produktcodes bilden.
- 01 Aktive chirurgische Geräte 02 Passive chirurgische Geräte 03 Neurologische und kardiovaskuläre chirurgische Geräte 04 Orthopädische chirurgische Geräte 05 Strahlentherapiegeräte 06 Medizinische Bildgebungsgeräte 07 Medizinische Diagnose- und Überwachungsgeräte 08 Beatmungs-, Anästhesie- und Erste-Hilfe-Geräte 09 Physiotherapiegeräte 10 Bluttransfusions-, Dialyse- und extrakorporale Zirkulationsinstrumente 11 Desinfektions- und Sterilisationsgerät Arten von Medizinprodukten 12 Aktive implantierbare Geräte 13 Passive implantierbare Geräte 14 Injektions-, Pflege- und Schutzgeräte 15 Patientenlagergeräte 16 Ophthalmologische Geräte 17 Zahnmedizinische Instrumente 18 Gynäkologische und geburtshilfliche, assistierte Reproduktions- und Empfängnisverhütungsgeräte 19 Medizinische Rehabilitationsgeräte 20 Geräte für die TCM 21 Medizinische Software 22 Klinische Untersuchungsinstrumente
Wir haben ein erstes Tool zum Nachschlagen von Produktcodes auf Englisch erstellt. Indem Sie die Produktschlüsselwörter auf Englisch eingeben, können Sie den Produktcode einfach suchen.
Wie in Abbildung 1 dargestellt, gehört das Beispiel medizinischer Software zu 21-xx-xx (Standalone Medical Software). In 5 Unterkategorien entspricht das Produkt der Therapieplanungssoftware 21-01-xx. Vergleichen Sie die letzten beiden Ziffern mit unterschiedlichen Verwendungszwecken im Katalog. Dies führt zum Ergebnis des Produktcodes 21-01-01, Strahlentherapie-Planungssoftware, Klasse III.
Der Mensch beginnt, den Verwendungszweck des betreffenden medizinischen Geräts mithilfe von Schlüsselwörtern im Produktcode-Katalog zu vergleichen. Zu betonen ist, dass Ihr medizinisches Gerät INNERHALB des Beschreibungsbereichs im Produktcode-Katalog liegen muss, NICHT identisch sein darf, jedoch NICHT darüber hinausgehen darf. Die Klassifizierung von Medizinprodukten ist im Katalog angegeben.
Wenn Sie den Produktcode kennen, können Sie sich den Ausnahmekatalog für klinische Studien anzeigen lassen. Bitte vergleichen Sie auch die Beschreibung in diesem Katalog. Unter demselben Produktcode kann es je nach Verwendungszweck für klinische Studien ausgenommen werden oder umgekehrt.
Am Ende können Sie nach produktspezifischen Richtlinien und Standards mit identifiziertem Produktcode suchen.
Guter Trend!
Jedes Jahr gibt die NMPA eine überarbeitete Liste der festgelegten neuen Produktklassifizierungen heraus. Der gute Trend besteht darin, dass immer mehr Medizinprodukte aufgrund geringerer Sicherheitsbedenken und der steigenden Menge gleichwertiger Produkte auf dem Markt herabgestuft werden.
So ermitteln Sie die Klassifizierung
Wenn Sie Ihr Medizinprodukt nicht dem Klassifizierungskatalog zuordnen können, können Sie (kostenlos) die Bestimmung der Produktklasse beantragen.
Die Ergebnisse können sein
1. Kein medizinisches Gerät
2. Medizinprodukt mit entsprechendem Produktcode, Klasse I oder II und III
3. Medizinprodukt der Klasse III
Sie müssen darauf achten, folgende Dokumente einzureichen:
· Anmeldeformular
· Produktbild und Strukturdiagramm
· Technische Produktanforderungen und Gebrauchsanweisung
· Ggf. Heimatlandbescheinigung
· Aussage zur Wahrhaftigkeit
· Weitere Dokumente, die die Bestimmung der Produktklasse unterstützen
· Ähnliche Produkte, die innerhalb und außerhalb Chinas zugelassen sind, Vergleich mit verwandter Produktklasse im Klassifizierungskatalog
· In Kernpublikationen veröffentlichte wissenschaftliche Arbeiten, Monographien und Dokumentenrezensionen, die gegebenenfalls den klinischen Anwendungswert des Produkts vollständig erläutern können
· Innovativer Inhalt des Produkts
· Neuheitsberichte von Informations- oder Patentrechercheagenturen
Kontaktieren Sie uns über info@easychinapprov.com, wenn Sie Ihren chinesischen Produktcode und Ihre Klassifizierung abgleichen möchten.
Es handelt sich nicht um eine feste Bestimmung der Produktklasse, Sie können Ihren chinesischen Verwendungszweck anpassen, Sie können Ihre Verwendungsindikation kürzen, Sie können einen Verwendungszweck für ein nichtmedizinisches Gerät und einen anderen für einen beabsichtigten medizinischen Zweck festlegen.
Verwandter Link zum internationalen Produktcode (Klassifizierungscode, JMDN, GMDN, MDR-Code)
Globale Nomenklatur für Medizinprodukte (GMDN)
FDA, Produktcode
PMDA, Japanische Medizinprodukte-Nomenklatur (JMDN)
Europa, MDR-Code
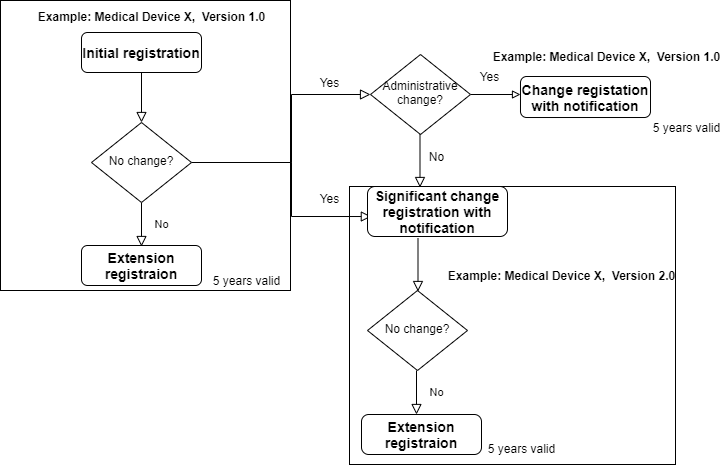
Art der Registrierung des Medizinprodukts
In China gibt es drei Arten der Produktregistrierung von Medizinprodukten:
- ErstregistrierungÄnderungsregistrierung (in Verwaltungsangelegenheiten und bei wesentlichen Änderungen/Modifikationen)Verlängerung/Erneuerung
Wie in Abbildung 3 dargestellt, gilt die Änderungsregistrierung normalerweise für neue Produktveröffentlichungen, für die eine neue „Konformitätserklärung“ erforderlich ist. Das Produktzertifikat ist nicht unbegrenzt gültig. Das Zertifikat für Medizinprodukte der Klassen II und III ist nur 5 Jahre gültig.
1. ErstregistrierungGilt für alle Medizinprodukte, die erstmals in China gekennzeichnet werden.
2. Änderungsregistrierung oder Neuregistrierung Es gibt zwei Arten der Änderungsregistrierung: in Verwaltungsangelegenheiten und bei erheblichen Änderungen/Modifikationen.
*Die Änderungsregistrierung in wesentlichen Änderungsangelegenheiten wird im Text abgekürzt, um die Registrierung auf der gesamten Website zu ändern
Änderungsanmeldung (in Verwaltungsangelegenheiten) Durch Änderung von:
- Name oder Adresse des ausländischen Herstellers, Name oder Adresse des chinesischen Vertreters
Änderungs-/Modifikationsregistrierung (in wesentlichen Änderungsangelegenheiten) Durch Änderung von:
- Adresse des ausländischen ProduktionsstandortsModelle, Spezifikationen, Struktur, Zusammensetzung, vorgesehene Verwendung im Zertifikat!Anhang des Zertifikats: Technische Produktanforderung (PTR)!Modell, VarianteZusammensetzung, Konfiguration, Kernkomponente, MaterialBeabsichtigte VerwendungNeue Funktionen mit unterschiedlichen funktionalen LeistungsspezifikationenNeue Softwareversion in erheblicher Änderungssache!
(z. B. Version 1.0 zu Version 2.0 mit Änderung der Softwareumgebung oder des Sicherheitsniveaus oder erheblicher Cybersicherheit usw.)
- Verbindliche Standards!
Anders als in der EU und den USA gibt es in China keine offiziellen Leitlinien, die alle wesentlichen Änderungen in Bezug auf die Änderungsregistrierung in Änderungsangelegenheiten angeben. Im Allgemeinen stellen alle Änderungen, die die Sicherheit oder Wirksamkeit des Produkts erheblich beeinträchtigen, wesentliche Änderungen des Medizinprodukts dar. Sollten neue oder überarbeitete produktspezifische Richtlinien und verbindliche Normen gelten, empfiehlt es sich, die nächste Änderungs- und Erweiterungsanmeldung rechtzeitig entsprechend den neuen Anforderungen vorzubereiten.
Dennoch offenbaren die neuen „Verordnungen zur Überwachung und Verwaltung von Medizinprodukten“ im Jahr 2021 in knapper Form die wesentlichen/wesentlichen Änderungen. Bitte verstehen Sie, dass wesentliche/wesentliche Änderungen nicht nur eine Benachrichtigung nach der Implementierung der Änderungen innerhalb von 30 Tagen an die NMPA bedeuten, sondern eine neue Änderungsregistrierung bedeuten.
Artikel 21 Das Design, die Rohstoffe, der Produktionsprozess, der Anwendungsbereich, die Verwendungsmethode usw. der registrierten Medizinprodukte II und III wurden erheblich geändert. Wenn es wahrscheinlich ist, dass die Sicherheit und Wirksamkeit des Medizinprodukts beeinträchtigt wird, müssen die Registranten bei der ursprünglichen Registrierungsabteilung die Durchführung der Verfahren zur Änderung der Registrierung beantragen; Wenn andere Änderungen auftreten, müssen diese gemäß den Vorschriften der Arzneimittelregulierungsabteilung des Staatsrates eingereicht oder gemeldet werden.
3. Verlängerung (Erneuerung des Zertifikats alle 5 Jahre)
Das NMPA-Zertifikat ist 5 Jahre gültig. Normalerweise sollten Sie mit der Vorbereitung der Erneuerung des NMPA-Zertifikats 6 Monate vor dem Ablaufdatum des Zertifikats beginnen, wenn keine wesentlichen Produktänderungen oder neue gültige Vorschriften vorliegen. Ähnlich wie bei der Änderungsregistrierung, wenn für Ihr Produkt neue verbindliche produktspezifische Normen gelten, müssen Sie ZUERST eine Änderungsregistrierung und ZWEITENS eine Erneuerung starten und dann ca. 1-2 Jahre vor Ablauf des Zertifikats.
Es ist derzeit nicht ungewöhnlich, dass die NMPA aufgrund der kürzlich gültigen Standards für die Haltbarkeit einen Haltbarkeitstest verlangt, der Gebrauchstauglichkeitstest wird wahrscheinlich bald folgen.
Artikel 22 der Verordnungen zur Überwachung und Verwaltung von Medizinprodukten im Jahr 2021
Unter folgenden Umständen wird die Registrierung nicht verlängert:
(1) Ein Antrag auf Erneuerung der Registrierung wurde nicht innerhalb der vorgeschriebenen Frist eingereicht;
(2) Die verbindlichen Standards für Medizinprodukte wurden überarbeitet und die Medizinprodukte, die eine Erneuerung der Registrierung beantragen, können die neuen Anforderungen nicht erfüllen;
(3) Bei bedingt zugelassenen Medizinprodukten werden die in der Zulassungsbescheinigung für Medizinprodukte genannten Punkte nicht innerhalb der vorgeschriebenen Frist erfüllt.
Verbindliche Regelung von 6 Monaten vor Beantragung einer Verlängerung (2021)
Wenn ein Medizinprodukt-Registrierungszertifikat abläuft und erneuert werden muss, sollte der Registrant sechs Monate vor Ablauf des Medizinprodukt-Registrierungszertifikats eine Erneuerung der Registrierung beantragen und die Antragsinformationen gemäß den relevanten Anforderungen einreichen. Da die Antragsinformationen unvollständig sind oder die gesetzliche Form der Berichtigung der Informationen nicht eingehalten wird, stellt die Behörde eine „Korrekturmitteilung“ aus, in der der Zeitpunkt des ersten Antrags des Registranten auf Verlängerung angegeben ist. Wenn der Registrant nach der Korrektur erneut eine Erneuerung der Registrierung beantragt, muss er die Korrekturmitteilung einreichen. Die Behörde stellt fest, ob der Antrag auf Erneuerung der Registrierung 6 Monate vor Ablauf der Registrierungsbescheinigung des Medizinprodukts entsprechend dem Zeitpunkt des ersten Antrags des Registranten auf Erneuerung der Registrierung gemäß der Berichtigungsmitteilung gestellt wird, und prüft die Antragsinformationen gemäß den Bestimmungen der Maßnahmen.
Verbindliche Regelung verbindlicher Standardhandlungen bei Erneuerung (2021)
Wenn seit dem 1. Oktober 2021 während der Gültigkeitsdauer (5 Jahre) des Medizingeräte-Registrierungszertifikats neue verbindliche Standards und nationale Standards veröffentlicht und umgesetzt werden, müssen die registrierten Produkte den neuen verbindlichen Standards und nationalen Standards entsprechen. Der Registrant sollte zunächst eine Änderung der Registrierung beantragen, die Originalgenehmigung einholen und dann einen Antrag auf Verlängerung stellen. Sind die Voraussetzungen erfüllt, wird der Antrag zur Prüfung und Genehmigung angenommen. Wenn die Anforderungen nicht erfüllt sind, wird der Registrant schriftlich benachrichtigt, um Korrekturen vorzunehmen.
Wenn die Registrierung geändert wird oder geändert werden soll, sollte der Registrant außerdem 6 Monate vor Ablauf der Registrierungsbescheinigung für Medizinprodukte eine Erneuerung der Registrierung beantragen. Die Behörde wird die Erneuerung der Registrierung gemäß den einschlägigen Bestimmungen dieses Rundschreibens durchführen.