Étapes d'enregistrement d'un dispositif médical en Chine (vidéo, instruction)
Autorité d'enregistrement des dispositifs médicaux en Chine
L'évaluation chinoise des dispositifs médicaux (CMDE) procède à un examen technique des dispositifs médicaux en Chine. La nouvelle législation concernant les dispositifs médicaux est publiée sur le site Web du CMDE, bien que son autorité supérieure, l'Administration nationale des produits médicaux (NMPA), soit la mieux connue et mentionnée.
Malheureusement, le site n'est pas traduit en anglais. Cependant, CMDE a un flux de travail élégant avec les étapes les plus importantes de l'enregistrement des dispositifs médicaux en Chine en anglais. Il est parfait pour les débutants même pour les spécialistes expérimentés en RA pour étudier des sujets intéressants derrière le flux de travail.
Si vous souhaitez télécharger les réglementations chinoises originales dans les "sujets d'enregistrement" intéressés, vous devez revenir au flux de travail chinois à l'aide d'un outil de traduction.
Flux de travail en vue d'ensemble
Flux de travail en vidéo expliqué
Flux de travail dans des scripts détaillés
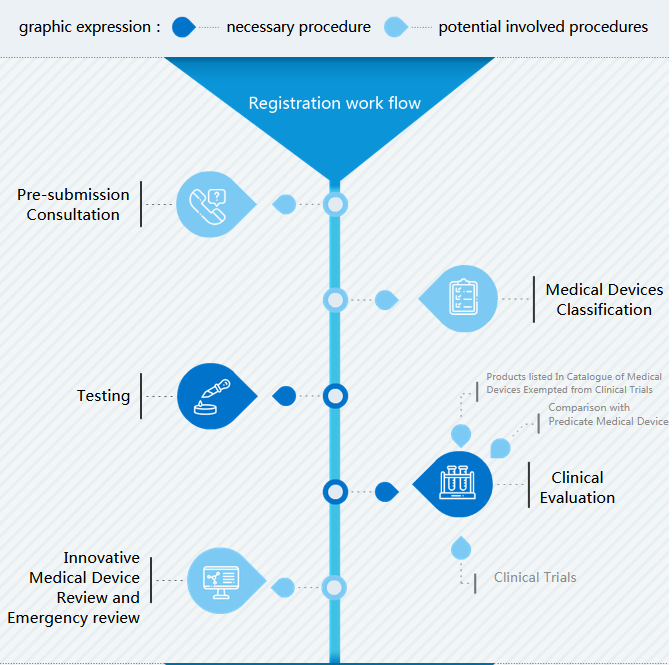
Le flux de travail de l'enregistrement des dispositifs médicaux en Chine est composé de trois parties :
- Flux de travail d'enregistrement avec des étapes importantes Examen et approbation sur le site de la NMPA (avant commercialisation) Type d'enregistrement (après commercialisation)
- I Enregistrement : L'étape importante avant la préparation des dossiers de soumission est de déterminer la classification. Lors de la préparation de l'enregistrement des dispositifs médicaux en Chine, les tests de type et l'évaluation clinique sont les parties les plus difficiles.
- II Examen et approbation : Après la soumission des dossiers techniques, le CMDE entreprend un examen d'acceptation au cours duquel l'exhaustivité des documents est prouvée et un examen technique après lequel des informations supplémentaires sont demandées.
- III Type d'enregistrement : Après l'enregistrement initial, c'est au tour du fabricant dans 5 ans de renouveler le certificat du produit. Si le dispositif médical subit des modifications importantes, un enregistrement de modification est nécessaire.
Je m'inscris
Classification des dispositifs médicaux
Il existe des dispositifs médicaux I, II et II en Chine. La meilleure façon de trouver la classification est de faire correspondre le code produit au catalogue de classification.
Si la classification ne peut pas être déterminée, le fabricant peut enregistrer directement le dispositif médical en tant que classe III ou demander la détermination de la classification auprès de la NMPA. S'il s'agissait d'un dispositif médical « spécial », une voie innovante peut être empruntée.
Essais (de type)
L'objet des essais de type est un dispositif médical de classe II et III. Le fabricant doit rédiger les exigences techniques du produit et sélectionner un centre de test.
Après l'envoi du dispositif médical en Chine, les tests seront effectués.
Évaluation clinique
Trois types d'évaluation clinique sont possibles en Chine : le CER simplifié si le dispositif médical est au catalogue exempté d'essai clinique, le CER comparant à des produits similaires qui sont approuvés en Chine et les essais cliniques en Chine.
Documents de demande d'inscription
La structure de soumission ici est dans le nouveau format de table des matières. Les documents dans ce format doivent être soumis via une soumission électronique de produits réglementés (eRPS).
Au flux de travail, seuls les principaux contenus et documents sont affichés dans les 6 meilleurs dossiers CH.
II Examen et approbation
Acceptation de la demande d'inscription
L'examen d'acceptation des dossiers de soumission est nouveau en raison d'un début de chaos dans la soumission électronique des dossiers via eRPS depuis 2019.
Dans les sous-dossiers (au niveau CH XX....), le fabricant doit soumettre le document correspondant, parfois même une déclaration dans les documents si le contenu ne s'applique pas à l'enregistrement du sujet.
Chaque fabricant légal qui possède un bureau physique et une licence commerciale en Chine peut demander une autorité de certification qui accède à l'utilisation du système eRPS. Pour le fabricant étranger sans sa propre entité chinoise, l'agent chinois assume normalement ce rôle.
Si les documents transmis via eRPS sont complets, le CMDE émet un "Avis d'Acceptation" et un "Bill of Payment". Dans le cas contraire, une "lettre d'insuffisance" ou un "avis de rejet" sont émis. Par "Deficiency Letter", le fabricant doit soumettre à nouveau l'ensemble des dossiers.
Supplémentaire (même examen technique, similaire à l'examen de fond des États-Unis)
Après examen technique, le fabricant dispose d'un délai d'un an pour fournir des informations supplémentaires conformément à la "Deficiency Letter".
Le temps de préparation des lacunes ne sera pas inclus dans le calendrier d'examen. Le fabricant peut consulter une fois les réviseurs pertinents.
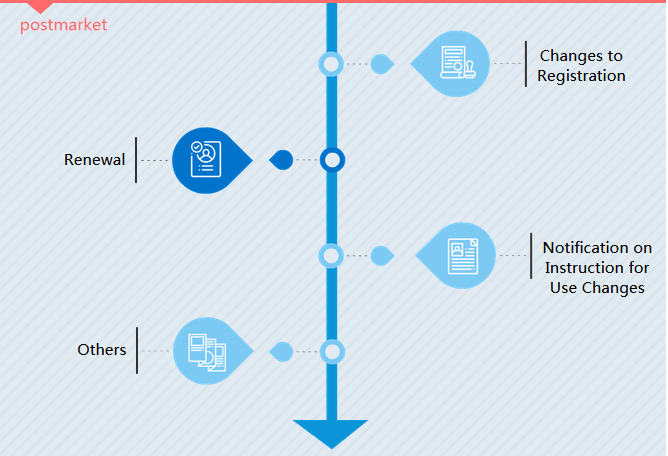
Type d'enregistrement
Modifications de l'inscription
Il existe deux types d'enregistrement des modifications. En langage CMDE, il s'agit de changements d'éléments de permission (question d'administration) et de changements d'éléments de registre (question de modification significative).
En Chine, il n'y a pas de "lettre à déposer" pour changement insignifiant de produit. Cependant, une évaluation des changements est recommandée pour le processus interne et en cas d'inspection par l'inspection chinoise.
Le délai d'examen technique lors d'un changement d'éléments de registre (question importante) par l'autorité est le même (60 jours ouvrables). Pour les changements d'éléments d'autorisation (question administrative), l'examen technique ne prend que 20 jours ouvrables.
Le dispositif médical d'enregistrement de changement a le même numéro de certification que lors de l'enregistrement initial. Le fabricant doit ensuite modifier les notices d'utilisation et les étiquettes en ajoutant le nouveau numéro de certification délivré et en mettant à jour la date de fabrication du dispositif médical approuvé (après la date de délivrance de la certification).
Renouvellement
Un certificat d'enregistrement de dispositif médical est valable 5 ans en Chine. Les fabricants doivent demander le renouvellement au plus tard 6 mois avant la date d'expiration du certificat.
Au moment du renouvellement, des efforts considérables comme lors de l'enregistrement des modifications sont nécessaires, si par exemple les normes obligatoires chinoises sont révisées. Cela signifie souvent de nouvelles exigences pour prouver la sécurité et l'efficacité du dispositif médical en termes de nouveaux essais de type qui déclenchent d'abord un nouvel enregistrement de changement avant le renouvellement.
Vidéo du processus d'inscription
Dans cette courte vidéo, CMDE vous donne un aperçu de la pré-soumission, de l'acceptation et de l'examen technique et de la consultation après la lettre de carence en Chine.